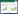中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 王桥美, 严亮, 胡先奇, 彭文书, 杨瑞娟, 刘丽, 刘沛, 东晔. 2021
- Qiaomei Wang, Liang Yan, Xianqi Hu, Wenshu Peng, Ruijuan Yang, Li Liu, Pei Liu, Ye Dong. 2021
- 茶轮斑病对茶树叶片内生真菌群落结构的影响
- Effects of tea grey blight on the community structure of endophytic fungi in tea leaves
- 微生物学报, 61(9): 2949-2961
- Acta Microbiologica Sinica, 61(9): 2949-2961
-
文章历史
- 收稿日期:2020-12-29
- 修回日期:2021-02-12
- 网络出版日期:2021-06-17
2. 滇西应用技术大学普洱茶学院, 云南 普洱 665000;
3. 普洱茶研究院微生物实验室, 云南 普洱 665000;
4. 云南农业大学食品科学技术学院, 云南 昆明 650201
2. College of Pu'er Tea, West Yunnan University of Applied Sciences, Pu'er 665000, Yunnan Province, China;
3. Laboratory of Microbiology, Pu'er Tea Research Institute, Pu'er 665000, Yunnan Province, China;
4. College of Food Science and Technology, Yunnan Agricultural University, Kunming 650201, Yunnan Province, China
植物内生真菌(plant endophytic fungi)是指那些在其生活史的一定阶段或全部阶段生活于健康植物各种组织和器官内部的真菌[1-2]。在长期协同进化过程中,与植物形成互利共生的关系,是植物微生态系统的重要组成部分[3]。在生物或非生物胁迫因素的生态系统中,内生真菌起着重要的生态学作用[4]。已有研究发现许多内生真菌与宿主植物的抗病、抗虫和抗旱性等有关[5-6]。茶树(Camellia sinensis)是中国重要的经济作物,在长期生长过程中,已形成独特的内生真菌群。已有研究表明,茶树内生真菌之间可以体现共生、拮抗和寄生3种不同类型的相互作用关系[7-9]。无论是共生、拮抗还是寄生作用,内生真菌之间最终会形成某种平衡关系,从而使茶树体内形成比较稳定的内生菌体系,这种协同作用可以提供对茶树的保护作用[9]。然而,随着茶树的生长,在外界条件变化或受到非生物和生物因素胁迫时,这种平衡会受到破坏,可能表现为某些菌群的优势生长,内生真菌菌群的分布就会发生改变。
茶轮斑病(tea grey blight)是一种重要的茶树叶片病害,其病原菌为真菌拟盘多毛孢属(Pestalotiopsis sp.)[10],病原菌常常从叶尖或者叶缘开始侵染,随后形成病斑造成叶片组织坏死[11]。这种病菌的侵入对茶树造成的生物胁迫,可能会导致某些菌群优势生长,破坏茶树叶片内生真菌的平衡体系。有研究表明[12],内生真菌可通过代谢产物对其他植入茶叶的微生物产生共生、偏共生或抑制作用的影响,而有些真菌又能通过重寄生的关系,影响寄主内生真菌的生长,改变内生真菌的菌群分布。目前,关于茶树内生真菌分离鉴定的研究很多[13-16],但大多仅限于用传统分离培养的方法,获得少数可培养的内生真菌,对其抗病、抗虫、抗旱等功能进行研究,利用高通量测序的方法对茶叶内生真菌群落结构组成的系统研究尚少见报道。本研究采用高通量测序法,对健康茶树叶片和茶轮斑病发病茶树的未病叶片内生真菌基因组进行测序,比较分析两者的内生真菌群落结构组成,以初步明确茶叶内生真菌的核心菌群分布,探索病原真菌侵染对茶树叶片内生真菌群落结构的影响,初步建立一种内生真菌协防关系,并将这种关系运用于茶叶的病害防治中,为茶树病害防治提供理论依据,同时为病菌的致病机理研究奠定基础。
1 材料和方法 1.1 样品采集及处理茶叶样本于2019年8月采自于云南省普洱市整碗村(22°75′41.2″N, 100°87′78.7″E)祖祥高山有机茶园基地。基地平均海拔1304.9 m,年平均气温17.80 ℃,年降水量1330.00 mm,茶树品种为云抗10号。每年的8月为茶树轮斑病发病的高峰期。发病特点是同一地块相同品种的茶树,有的茶树容易发病,有的茶树不发病。本实验选择具有以上特点的不同位置的茶园6块(6个重复),在同一地块分别采集茶轮斑病发病茶树的未病叶片和健康茶树的叶片2组样本,发病组命名为YNB,健康组命名为YNJ,每组6个重复样本,共12个样本(图 1)。采样方法为5点取样法,每个样本由5个子样本混合而成。所有样本均采自茶树修剪台面上的老叶片。采集后的样品带回实验室,用75%酒精浸泡1 min,无菌水冲洗3次,再用5% (有效氯)次氯酸钠表面消毒5 min,无菌水冲洗3次,在无菌操作台风干后–80 ℃保存备用[17]。

|
| 图 1 茶轮斑病发病茶树(A) 与健康茶树(B) 图片 Figure 1 Pictures of diseased (A) and healthy tea tree leaves (B). |
1.2 试剂材料
PowerSoil® DNA Isolation Kit试剂盒(深圳市安必胜科技有限公司,12855-50),AxyPrep DNA凝胶回收试剂盒(AXYGEN公司),PCR扩增酶KOD FX Neo (TOYOBO),50 mL冻存管,液氮。
1.3 仪器设备PowerLyzer™ 24 Bench Top Bead-Based Homogenizer珠磨研磨设备(深圳市安必胜科技有限公司),Vortex-Genie®2涡旋仪(MO BIO货号13111-V-220),微型离心机(TIANGEN型号1795),振荡器(SI型号G560E),96 well PCR仪(AB型号9002),24孔离心机(Eppendorf型号5424EQ766751)。
1.4 总DNA提取表面消毒处理后的叶片样本采用PowerLyzer™ 24 Bench Top Bead-Based Homogenizer珠磨研磨设备(深圳市安必胜科技有限公司)进行研磨,采用微生物通用试剂盒PowerSoil® DNA Isolation Kit (深圳市安必胜科技有限公司,12855-50),按生产商提供的步骤快速提取内生真菌基因组DNA,用1%琼脂糖凝胶电泳检测DNA提取质量。
1.5 ITS rDNA序列扩增及测序将提取的总DNA作为模板,以ITS1 (5′-CTTG GTCATTTAGAGGAAGTAA-3′)和ITS4 (5′-GCTGC GTTCTTCATCGATGC-3′)为引物对真菌ITS1区域进行扩增[18]。PCR扩增体系为(50 μL):模板DNA 40–60 ng/5 μL,Vn F (10 μmol/L) 1.5 μL,Vn R (10 μmol/L) 1.5 μL,KOD FX Neo (ToYoBo) 1 μL,KOD FX Neo Buffer (2×) 25 μL,2 mmol/L dNTPs 10 μL,ddH2O补至总体积50 μL。PCR反应条件为:95 ℃ 5 min;95 ℃ 1 min,50 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃ 7 min。反应产物用1%琼脂糖凝胶电泳检测。PCR扩增及测序工作由上海百趣生物医学科技有限公司完成,测序平台为HiSeq 2500平台。
1.6 数据分析用FLASH v1.2.7软件拼接双端测序序列,用Trimmomatic v0.33软件过滤Raw Tags,用Usearch软件对相似度在97%水平下的Tags进行聚类、获得OTU (operational taxonomic units),并基于UNITE (真菌)分类学数据库对OTU进行分类学注释。利用QIIME软件生成不同分类水平的物种丰度表,利用R语言工具绘制成样品各分类学水平下的群落结构。用Mothur (version v.1.30)软件评估样品的Alpha多样性指数。用QIIME软件进行Beta多样性分析。用Metastats软件对组间的物种丰度数据进行T检验,比较组间微生物的显著性差异。用SparCC算法进行相关分析,筛选相关性大于0.1且P值小于0.05的数据组,基于python绘制共表达分析网络图,呈现物种间的相关性。
2 结果和分析 2.1 基因序列分析 2.1.1 测序序列特征:对12个样本内生真菌的ITS1区进行测序,共得到高质量质控序列874234条,平均长度246 bp,对所有序列在97%的相似度水平下进行聚类,共获得942个OTU (表 1)。将OTU的代表序列与微生物参考数据库进行比对注释,得到每个OTU对应的物种分类信息,统计为9个门、25个纲、60个目、120个科、190个属,由于大部分OTU只能鉴定到属分类水平,因此,在种分类水平上只注释了153个种。
| Sample ID | Effective tags | Avg len/bp | OTU |
| YNB1 | 77092 | 249 | 286 |
| YNB2 | 77198 | 250 | 242 |
| YNB3 | 76646 | 251 | 592 |
| YNB4 | 76472 | 253 | 593 |
| YNB5 | 75556 | 272 | 238 |
| YNB6 | 76714 | 257 | 287 |
| YNJ1 | 74834 | 243 | 270 |
| YNJ2 | 51491 | 234 | 285 |
| YNJ3 | 63299 | 228 | 606 |
| YNJ4 | 74827 | 242 | 550 |
| YNJ5 | 75036 | 238 | 618 |
| YNJ6 | 75069 | 239 | 589 |
| Total | 874234 | 246 | 942 |
两组样本测序序列稀释曲线如图 2所示,由图可知,随着测序得到的序列条数增加,曲线首先急剧上升,而后分为2组先后趋于平缓,表明2组样本的测序量都足够反映其微生物的多样性。此外,YNB的6个样本曲线聚在一组,YNJ的6个样本曲线聚在另外一组。趋于平缓时YNJ组测序到的OUT为500–600,而YNB组为200–280,说明YNJ组的OTU数量及多样性明显高于YNB。
|
| 图 2 茶树叶片内生真菌稀释曲线 Figure 2 Rarefaction curve of endophytic fungi of tea leaves. |
2.1.2 OTU聚类分析:
2组样本的OTU数量及相似性分析如图 3所示,重叠部分表示2组样品中共有的OTU数(物种),共有513个OTU。没有重叠的部分表示2组样品中各自特有的物种。YNJ组共有867个物种,特有物种354个,YNB组共有588个物种,特有物种75个。结果显示,YNB组无论是物种总数还是特有物种的数量都显著低于YNJ组,说明YNB组的物种多样性显著低于YNJ。

|
| 图 3 茶树叶片内生真菌OTU韦恩图 Figure 3 Venn diagrams of endophytic fungi OTUs of tea leaves. |
2.2 Alpha多样性分析
对2组样本的Alpha多样性指数ACE、Chao1、Shannon、Simpson分析如图 4所示。图 4-A–C显示,YNB组的ACE、Chao1、Shannon指数均显著低于YNJ (P < 0.01),图 4-D显示,YNB的Simpson指数极显著高于YNJ。Chao1和ACE指数衡量物种的丰度,Shannon和Simpson指数衡量物种多样性。且ACE、Chao1、Shannon指数越高,Simpson指数越低,说明样本的多样性和丰度越高,反之亦然。因此,以上结果表明YNB组的内生真菌无论是丰度还是多样性均显著低于YNJ。由此可知,茶轮斑病的发生降低了茶叶内生真菌的丰度和多样性。

|
| 图 4 茶树叶片内生菌多样性指数 Figure 4 Alpha diversity index of endophytic fungi of tea leaves. A, B, C, D represent ACE, Chao1, Shannon and Simpson analysis, respectively. *: P < 0.05; **: P < 0.01. |
2.3 样品微生物群落组成分析
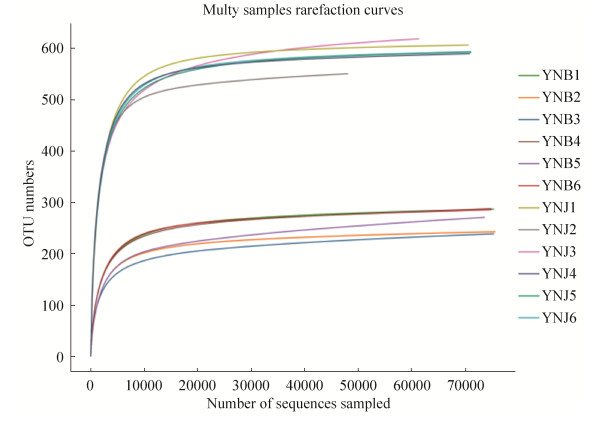
利用QIIME软件对2组样本获得的OTU在不同分类水平上进行注释分类,丰度前10的物种分布如图 5所示。由图可知,在门分类水平(图 5-A)上,丰度最高的前10个门是子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、球囊菌门(Glomeromycota)、油壶菌门(Olpidiomycota)、罗兹菌门(Rozellomycota)、壶菌门(Chytridiomycota)、捕虫霉门(Zoopagomycota)、隐真菌门(Aphelidiomycota)和未分类类群。其中子囊菌门(Ascomycota)在YNB和YNJ中的相对丰度均较高,分别占总序列的58.60%和56.93%,是茶树叶片内生真菌的优势门。
|
| 图 5 不同分类水平菌群分布柱状图 Figure 5 Histogram of flora distribution at different taxonomic levels. A, B, C represent the flora distribution map of phylum, family and genus, respectively. |
科分类水平(图 5-B)上,2组样本中丰度前10的物种是Sporocadaceae、小丛壳科(Glomerellaceae)、枝孢霉科(Cladosporiaceae)、丛赤壳科(Nectriaceae)、Trichosphaeriaceae、中国毛壳菌科(Chaetomiaceae)、小不整球壳科(Plectosphaerellaceae)、曲霉科(Aspergillaceae)、被孢霉科(Mortierellaceae)、角担菌科(Ceratobasidiaceae)和未分类类群。YNB组中,丰度较高的是Sporocadaceae、小丛壳科(Glomerellaceae)、枝孢霉科(Cladosporiaceae),分别占总序列的19.81%、19.08%和6.01%。YNJ组中,丰度较高的是Sporocadaceae、小丛壳科(Glomerellaceae),分别占总序列的6.92%和7.33%,其余类群丰度差异不显著。Sporocadaceae和小丛壳科(Glomerellaceae)同为YNB和YNJ的优势类群,但在两组中的相对丰度差异显著。
属分类水平(图 5-C)上,2组样本中丰度前10的物种是炭疽菌属(Colletotrichum)、假拟盘多毛孢属(Pseudopestalotiopsis)、枝孢属(Cladosporium)、黑孢霉属(Nigrospora)、被孢霉属(Mortierella)、亡革菌属(Thanatephorus)、曲霉属(Aspergillus)、节菱孢属(Arthrinium)、轮枝孢属(Verticillium)、Plectosphaerella和未分类类群。YNB组中,炭疽菌属(Colletotrichum)和假拟盘多毛孢属(Pseudopestalotiopsis)为优势菌群,分别占总序列的19.07%和15.81%。YNJ组中,枝孢属(Cladosporium)为优势菌群,占总序列的7.33%。
2.4 Beta多样性分析使用QIIME软件对样本进行Beta多样性分析,比较2组样本在物种多样性方面存在的差异,结果如图 6所示。由图可知,12个样本分为两大分支,YNB组的6个重复样本聚为一个大支,YNJ组的6个重复样本聚为另一个大支,结果显示,样本组间聚类明显,说明茶轮斑病的发生改变了茶树叶片内生真菌的群落结构组成。

|
| 图 6 茶树叶片样本UPGMA聚类树 Figure 6 The UPGMA clustering tree of tea leaves. |
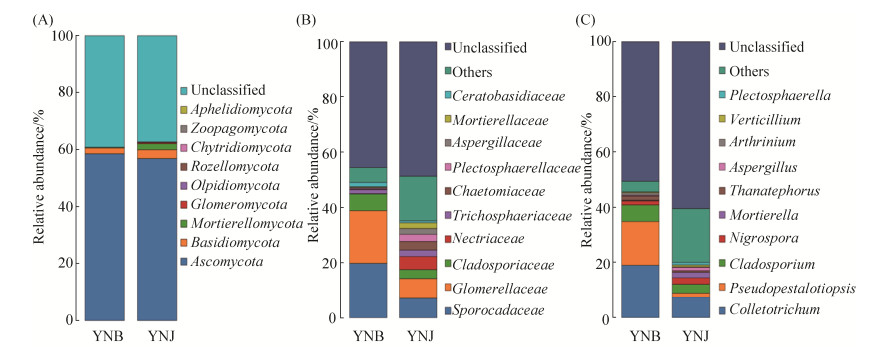
对样本进行距离矩阵主成分分析,得到主坐标分析(PCA)三维图如图 7所示。由图可知,PC1、PC2和PC3的贡献率分别为67.18%、19.38%和5.85%。12个样本大概分成了2个分布区,YNB组的6个样本聚在一个区,样本间的距离较小,说明YNB组中样本微生物群落的组成结构相似。而YNJ组的6个样本聚在另一个区,样本间的距离稍大,说明YNJ组中的样本微生物群落的组成结构有一定差异。主成分分析结果进一步说明发病组叶片和健康组叶片的内生真菌的群落结构组成有显著差异。
|
| 图 7 茶树叶片内生真菌群落结构的三维主坐标分析 Figure 7 3D principal component analysis of endophytic fungi community structure of tea leaves. |
2.5 组间显著差异微生物分析
对发病组和健康组样本的差异物种进行秩和检验,比较2组间物种差异的显著性,结果如图 8所示。在门分类水平上(图 8-A),YNB与YNJ2组样本在被孢霉门(Mortierellomycota)、球囊菌门(Glomeromycota)、油壶菌门(Olpidiomycota)、罗兹菌门(Rozellomycota)和壶菌门(Chytridiomycota)上有显著差异(P < 0.05),其中,在YNJ组中所占相对丰度比列分别为2.10%、0.44%、0.11%、0.05%、0.03%、在YNB组中所占相对丰度比列分别为0.23%、0.02%、0.0002%、0%和0.0038%,各门在YNJ中的比例显著高于YNB。

|
| 图 8 不同分类水平的组间差异微生物秩和检验(P<0.05) Figure 8 Wilcoxon rank-sum test on different taxonomic levels of differential microorganisms between groups. A, B, C represent the different flora of phylum, family and genus, respectively. |
在科分类水平上(图 8-B),Sporocadaceae、小丛壳科(Glomerellaceae)、枝孢霉科(Cladosporiaceae)在YNB组中比例显著高于YNJ组(P < 0.05),各科在YNB中所占比例为19.74%、19.07%和5.99%,在YNJ中所占比列为6.57%、7.01%和3.17%。毛球壳科(Lasiosphaeriaceae)、曲霉科(Aspergillaceae)、被孢霉科(Mortierellaceae)、小不整球壳科(Plectosphaerellaceae)、毛壳菌科(Chaetomiaceae)和丛赤壳科(Nectriaceae)在YNB组中比例显著低于YNJ组(P<0.05),各科在YNB中所占相对丰度依次为0.07%、0.33%、0.23%、0.33%、0.15%和0.15%,在YNJ中所占相对丰度比列依次为1.78%、2.16%、2.07%、2.62%、3.19%和4.87%。
在属分类水平上(图 8-C),假拟盘多毛孢属(Pseudopestalotiopsis)、炭疽菌属(Colletotrichum)和节菱孢属(Arthrinium)在YNB中所占的相对丰度比例显著高于YNJ (P < 0.05),在YNB中的比例分别是15.75%、19.07%和0.91%,在YNJ中的比例分别为1.52%、7.01%和0.11%。被孢霉属(Mortierella)、曲霉属(Aspergillus)、Plectosphaerella、Lectera、Botryotrichum、青霉菌属(Penicillium)、赤霉属(Gibberella)、毛壳菌属(Chaetomium)、Lulwoana和轮枝孢属(Verticillium)在YNJ中所占的相对丰度比列显著高于YNB (P < 0.05),在YNJ中的比例分别为2.01%、1.24%、0.93%、0.78%、0.78%、0.76%、0.63%、0.58%、0.54%和0.73%,在YNB中的比例分别是0.22%、0.29%、0.03%、0.01%、0.01%、0.04%、0.0028%、0.03%、0.01%和0.24%。
2.6 物种间相关性分析对样本中的物种进行相关性分析,属分类水平上丰度最高的前80个属物种相关性如图 9所示。由图可知,在叶片内生真菌中,丰度最高的属是炭疽菌属(Colletotrichum),其次为假拟盘多毛孢属(Pseudopestalotiopsis),然后是枝孢属(Cladosporium)和黑孢霉属(Nigrospora),且它们之间呈现出较强的正相关关系。此外,在丰度较高的前80个属之间,大部分属之间都为正相关的关系,只有枝孢属(Cladosporium)和极少数的几个属之间表现出负相关的关系。

|
| 图 9 属分类水平各物种间的相关性网络图 Figure 9 Correlation network of species at genus level. Circle represents species, circle size represents abundance, line represents correlation between two species, line thickness represents correlation strength, line color: orange represents positive correlation, green represents negative correlation. |
3 讨论
茶叶内生真菌的核心菌群相对较固定,但受到不同因素的影响,菌群的丰度和数量会存在一些差异和变化。内生真菌和茶树长期共生,协同进化,他们之间的互作关系受茶树所含化学成分变化的影响。因此,不同茶树品种[7, 16, 19]、组织器官[9, 20]、生长季节[20-21]、地理位置[22-23]和生长状态[24-25]下的内生真菌群落结构也存在一定的差异。本研究采用高通量测序技术对健康茶叶和茶轮斑病菌感染茶树的未病茶叶内生真菌基因组进行检测,对内生真菌群落多样性进行分析。
通过研究发现,发病组和健康组茶叶内生真菌群落多样性和结构组成都有显著差异。在物种多样性方面,YNJ组的物种丰度和多样性均显著高于YNB。在群落结构方面,YNB组中假拟盘多毛孢属、炭疽菌属和节菱孢属的相对丰度显著较高,而YNJ中被孢霉属、曲霉属、Plectosphaerella、Lectera、Botryotrichum、青霉菌属、赤霉属、毛壳菌属、Lulwoana和轮枝孢属的相对丰度显著较高,相对于发病组,健康组内生真菌具有更丰富的物种多样性。正如张丽娜[26]描述的那样,内生菌群落的多样性及丰富度不仅体现了群落发育的阶段和稳定性,还体现了群落的生境特征,群落的演变过程中多样性和丰富度指数越高,群落的稳定性越好。由于微生物之间的拮抗排斥等相互作用,不利于病原菌发展成为优势种,从而不利于病害的发生。在优势菌方面也表现出了显著的差异,YNB组的优势菌群为炭疽菌属和拟盘多毛孢属,而YNJ组的优势菌为枝孢属。健康组茶叶中的优势菌群与汪立群等[16]、季爱兵[3]从普洱茶叶中分离到的优势菌一致。综上,茶轮斑病的发生改变了茶叶内生真菌的群落结构,使少数物种优势生长。这一结果与张丽娜[26]的研究结果一致,她对灰斑病山茶叶内生真菌的群落结构研究也得到了同样的结论。在生态学作用上,优势菌群对整个群落结构具有控制性的影响。茶树轮斑病病原菌假拟盘多毛孢属(Pseudopestalotiopsis)在健康茶叶和发病茶叶中都有分布,但在健康组中的数量较少,在发病组中为优势菌群,说明病原菌要导致病害的发生,必须在寄主植物上定植成为优势菌群。通过微生物之间的相关性分析发现,炭疽菌属、假拟盘多毛孢属和枝孢属之间存在很强的正相关,这与戴清良[9]的研究结果相吻合,戴清良将炭疽菌与拟盘多孢菌混合发酵培养形成的菌丝球比单独发酵大,同时产生的孢子更多。由此我们推断,可能发病组茶叶中病原菌假拟盘多孢属菌群增加,促进了炭疽菌属真菌的生长,而由于营养竞争和生态位的竞争作用[8],抑制了与其负相关菌群的生长,从而导致发病组茶叶内生真菌群落结构的改变。通过研究,明确了发病茶叶内生真菌的菌落结构组成,可为致病机理的研究提供借鉴。
植物内生菌是个潜在的微生物新资源,具有重要的农业生产应用潜力。内生菌对外源微生物感染有抑制作用,还可诱导寄主植物的抗性表达。经研究发现,茶树内生青霉菌对茶轮斑病菌和茶云纹叶枯病菌具很强的抑制作用[7];内生淡紫拟青霉FHM发酵液对茶芽枯病菌、茶轮斑病菌和茶炭疽病菌等茶树病原真菌有抑制作用[27];内生炭疽菌能诱导茶叶细胞产生抗性反应等[9]。据此,我们可有针对性地从茶树叶片中提取具有生防作用的菌株,利用其特定的生防功能,开发生防菌制剂,对茶树病害进行靶向防治。此外,还可利用内生菌的固氮、促生长以及对污染土壤的生物修复作用发展农业,以减少化肥和化学药剂的使用,为全球农业的可持续发展作出贡献。
4 结论本研究对健康茶叶和发病茶叶的12份样本以ITS rRNA基因序列分析法进行内生真菌群落多样性研究发现,发病组的内生真菌菌群丰度和多样性均低于健康组,2组样本的内生真菌群落结构也有显著性差异,YNB组的优势属为炭疽菌属和假拟盘多毛孢属,YNJ的优势属为枝孢属,综上,YNB组的内生真菌多样性低,物种的分布不均匀,表现为少数物种的优势生长。而YNJ组中,内生真菌的多样性高,物种的分布较均匀,叶片内生菌之间的平衡关系相对较稳定,因而表现为健康生长。通过研究,明确了真菌病害对茶叶内生真菌群落结构的影响作用,为病原菌的致病机理研究提供借鉴,为茶树病害防治提供理论依据。
| [1] |
Chen JY, Chen XX, Luo XL, Yang CR, Zhang YJ, Li SZ, Jiang HJ, Zhao P. The phytopathogenic antagonistic activity of endophytic fungi from Xiangzhuqing ancient cultivated tea. Journal of Yunnan Agricultural University (Natural Science), 2020, 35(3): 422-429.
(in Chinese) 陈建英, 陈肖学, 罗旭璐, 杨崇仁, 张颖君, 李绍忠, 江鸿建, 赵平. 香竹箐栽培型古茶树内生真菌对植物病原真菌的拮抗活性. 云南农业大学学报(自然科学), 2020, 35(3): 422-429. |
| [2] |
Wang XP, Tan RR, Cao D, Gong ZM. Research Progress on Endophytic Fungi of Camellia sinensis. Hubei Agricultural Sciences, 2015, 54(23): 5808-5812.
(in Chinese) 王雪萍, 谭荣荣, 曹丹, 龚自明. 茶树内生真菌研究进展. 湖北农业科学, 2015, 54(23): 5808-5812. |
| [3] | 季爱兵. 普洱茶叶片中内生菌的鉴定. 吉林大学硕士学位论文, 2013. |
| [4] |
Guo BH. Current status and prospects of ecological roles and natural products of endophytes in plants. Jiangsu Agricultural Sciences, 2019, 47(20): 13-19.
(in Chinese) 郭宾会. 植物内生菌的生态学作用与天然产物研究现状及展望. 江苏农业科学, 2019, 47(20): 13-19. |
| [5] |
Niu YF, Li YP, Luo FC, Chen ZB, Peng SJ, Chen WR, Zi TP. Promotion mechanisms on endophyte of plant to growth and stress tolerance of hosts plant. Grassland and Turf, 2015, 35(2): 91-96.
(in Chinese) 牛燕芬, 李扬苹, 罗富成, 陈泽斌, 彭声静, 陈武荣, 字泰平. 植物内生真菌对寄主生长及抗逆性的增效机理研究进展. 草原与草坪, 2015, 35(2): 91-96. DOI:10.3969/j.issn.1009-5500.2015.02.020 |
| [6] |
Chen LY, Hu LP, Wang ZB. Effects of endophytic alcohol extract on growth and stress resistance of cockscomb. Acta Agriculturae Jiangxi, 2020, 32(3): 61-64.
(in Chinese) 陈利云, 呼丽萍, 汪之波. 内生菌醇提取物对鸡冠花生长与抗逆性的影响. 江西农业学报, 2020, 32(3): 61-64. |
| [7] | 谢丽华. 茶树内生真菌的分离、相互作用关系及菌株抗菌活性成分的初步研究. 福建师范大学硕士学位论文, 2007. |
| [8] | 武汉琴. 茶树内生真菌与宿主植物相互作用的初步研究. 福建师范大学硕士学位论文, 2009. |
| [9] | 戴清良. 茶树内生真菌的相互作用、内生性及抗菌活性研究. 福建师范大学硕士学位论文, 2008. |
| [10] |
Wen XD, Song XC, Wang Y, Ren YF, Li DX, Chen Z. Biological characterization of Pseudopestalotiopsis camelliae-sinensis causing tea grey blight. China Plant Protection, 2018, 38(10): 19-25.
(in Chinese) 文小东, 宋星陈, 王勇, 任亚峰, 李冬雪, 陈卓. 茶轮斑病病原菌(Pseudopestalotiopsis camelliae-sinensis)生物学特性研究. 中国植保导刊, 2018, 38(10): 19-25. DOI:10.3969/j.issn.1672-6820.2018.10.003 |
| [11] | 任亚峰. 茶假拟盘多毛孢的药剂活性筛选以及抑菌机制的研究. 贵州大学硕士学位论文, 2019. |
| [12] |
Qiao HP, Zong ZF. Biological control of plant pathogens with hyperparasites. Chinese Journal of Biological Control, 2002, 18(4): 176-179.
(in Chinese) 乔宏萍, 宗兆锋. 用重寄生菌防治植物病害. 中国生物防治, 2002, 18(4): 176-179. |
| [13] |
Wang XP, Gong ZM, Tan RR, Cao D, Gao SW, Zheng PC, Ye F, Wang SP, Teng J, Zheng L, Liu PP. Diversity and population structure of endophytic fungi from Camellia sinensis in Wuhan, Hubei. Hubei Agricultural Sciences, 2016, 55(21): 5563-5566, 5573.
(in Chinese) 王雪萍, 龚自明, 谭荣荣, 曹丹, 高士伟, 郑鹏程, 叶飞, 王胜鹏, 滕靖, 郑琳, 刘盼盼. 湖北武汉茶树内生真菌多样性及种群结构. 湖北农业科学, 2016, 55(21): 5563-5566, 5573. |
| [14] |
Liu SS. Isolation and determination of antagonistic activities of endophytic fungi from tea trees. Guizhou Agricultural Sciences, 2019, 47(12): 58-63.
(in Chinese) 刘诗诗. 茶树内生真菌的分离及广谱抑菌菌株的筛选鉴定. 贵州农业科学, 2019, 47(12): 58-63. DOI:10.3969/j.issn.1001-3601.2019.12.014 |
| [15] |
Wang XX, Shao ZL, Tang XY, Pei SF, Huang M, Huang YF. Screening of endophytic fungi producing polyphenol oxidase from tea plant (Camellia sinensis) and its application in instant tea production. China Tea Processing, 2019(4): 38-43.
(in Chinese) 王晓霞, 邵增琅, 唐杏燕, 裴少芬, 黄鸣, 黄叶飞. 茶树产多酚氧化酶内生真菌的筛选及其在速溶茶生产中的应用. 中国茶叶加工, 2019(4): 38-43. |
| [16] |
Wang LQ, Yan XM, Guo XS, Zhang R, Mei Y, Wei CL. Diversity of endophytic microorganisms Zijuan and Yunkang 10 of Camellia sinensis. Journal of Anhui Agricultural University, 2016, 43(1): 1-5.
(in Chinese) 汪立群, 颜小梅, 郭小双, 张冉, 梅玉, 韦朝领. 紫娟、云抗10号两个茶树品种内生菌多样性研究. 安徽农业大学学报, 2016, 43(1): 1-5. |
| [17] |
Qiao XR. Research on advances of endophytes from Camellia sinensis. Journal of Xinyang Agriculture and Forestry University, 2018, 28(2): 106-109.
(in Chinese) 乔新荣. 茶树内生菌研究进展. 信阳农林学院学报, 2018, 28(2): 106-109. |
| [18] |
Zhuo N, Yi L, Hao SN, Jirimu T. Application of 16S rRNA high-throughput sequencing for comparative study of the microbial diversity of traditional fermented Bactrian camel milk from Alxa Bactrian camel and Sonid Bactrian camel. Acta Microbiologica Sinica, 2019, 59(10): 1948-1959.
(in Chinese) 卓娜, 伊丽, 浩斯娜, 吉日木图. 基于16S rRNA基因序列分析法比较苏尼特双峰驼和阿拉善双峰驼自然发酵酸驼乳的微生物多样性. 微生物学报, 2019, 59(10): 1948-1959. |
| [19] |
Zhu YJ, Chen L, Lan JL, Su MX, Liu B. Isolation, identification and the biocontrol potential of endophyte in theasienensis(Camellia sinensis). Journal of Fujian Agriculture and Forestry University: Natural Science Edition, 2009, 38(2): 129-134.
(in Chinese) 朱育菁, 陈璐, 蓝江林, 苏明星, 刘波. 茶叶内生菌的分离鉴定及其生防功能初探. 福建农林大学学报: 自然科学版, 2009, 38(2): 129-134. |
| [20] |
You JM. Dynamic distributes of endophytic fungi from Camellia sinensis. Guihaia, 2008, 28(1): 82-85.
(in Chinese) 游见明. 茶树中内生菌的动态分布. 广西植物, 2008, 28(1): 82-85. DOI:10.3969/j.issn.1000-3142.2008.01.015 |
| [21] |
Hu YF, Zhang Y, Zhang CL, Yang LC, Chen X, Zhuang J, Li XH. Diversity analysis of the endophytic fungi in root and fungi in rhizosphere soil of tea plant in different seasons. Journal of Nanjing Agricultural University, 2013, 36(3): 41-46.
(in Chinese) 胡雲飞, 张玥, 张彩丽, 杨路成, 陈暄, 庄静, 黎星辉. 茶树根系内生真菌与根际土壤真菌的季节多样性分析. 南京农业大学学报, 2013, 36(3): 41-46. |
| [22] | 王明好. 茶树内生真菌次生代谢物检测与分析. 信阳师范学院硕士学位论文, 2012. |
| [23] | 李小容. 茶树叶面真菌、内生真菌群落比较及其互作关系的初步研究. 福建师范大学硕士学位论文, 2009. |
| [24] | 徐焰平. 茶树内生芒果球座菌(Guignardia mangiferae)的鉴定、生态分布和遗传多样性分析. 福建师范大学硕士学位论文, 2009. |
| [25] |
Chen HQ, Xu YP, Xie LH, Wang GH, Yang MH. Isolation of endophytic fungi in teaplant (Camellia sinensis) and their distribution patterns in different tissues. Journal of Laiyang Agricultural College, 2006, 23(4): 250-254.
(in Chinese) 陈晖奇, 徐焰平, 谢丽华, 王国红, 杨民和. 茶树内生真菌的分离及其在寄主组织中的分布特征. 莱阳农学院学报(自然科学版), 2006, 23(4): 250-254. |
| [26] |
Zhang LN, Zhu TH, Yang ZZ, Zhang JF. Influence of Camellia gray spot disease on foliar fungal communities. Journal of Sichuan Agricultural University, 2011, 29(3): 378-385.
(in Chinese) 张丽娜, 朱天辉, 杨佐忠, 张继甫. 灰斑病对山茶叶部真菌群落的影响. 四川农业大学学报, 2011, 29(3): 378-385. DOI:10.3969/j.issn.1000-2650.2011.03.015 |
| [27] |
Li SF, Yang MH. Identification of an endophytic paecilomyces lilaeimls from a leaf of Camellia sinensis as well as determination of its anti-fungal activity. Biological Disaster Science, 2012, 35(1): 45-49.
(in Chinese) 李绍锋, 杨民和. 一株茶树内生淡紫拟青霉的鉴定及抗真菌活性研究. 生物灾害科学, 2012, 35(1): 45-49. |
 2021, Vol. 61
2021, Vol. 61